Con apenas unos milímetros de longitud, el Caenorhabditis elegans puede parecer un modelo insignificante frente a patologías humanas tan complejas como el Parkinson. Pero gracias al trabajo de Silvia Romero, doctoranda en el grupo de Envejecimiento y Calcio, este pequeño gusano ha demostrado ser clave para entender mejor la enfermedad y, aún más, para abrir nuevas vías terapéuticas.
El último estudio liderado por Romero ha demostrado el potencial del compuesto CGP37157 en modelos animales de Parkinson. Se trata de una benzotiazepina neuroprotectora capaz de modular la homeostasis del calcio —un proceso celular fundamental que se ve gravemente alterado en enfermedades neurodegenerativas asociadas a la edad—. “Este fármaco inhibe el intercambiador Na⁺/Ca²⁺, presente en las mitocondrias y en la membrana plasmática. Eso nos hizo pensar que podría tener efectos beneficiosos en enfermedades donde la regulación del calcio está descompensada, como el Parkinson”, explica la investigadora.

La elección del modelo experimental podría sorprender, pero la investigadora lo defiende con rotundidad: los C. elegans comparten más del 60 % de sus genes con los humanos y reproduce muchas de nuestras vías moleculares. A ello se suman ventajas prácticas como su transparencia —que permite observar procesos celulares en vivo mediante proteínas fluorescentes—, su manipulación genética sencilla mediante ARN de interferencia, y una tasa reproductiva elevada que facilita resultados estadísticamente sólidos. Pero, sobre todo, destaca un detalle crucial: este gusano posee neuronas dopaminérgicas, las mismas que se ven afectadas en la enfermedad de Parkinson. Estas neuronas son células nerviosas encargadas de producir y liberar dopamina, un neurotransmisor esencial para funciones como el control del movimiento, la motivación o el aprendizaje. Se localizan principalmente en una región del cerebro, conocida como la sustancia negra, y su degeneración progresiva es una de las principales causas de esta enfermedad.
La enfermedad de Parkinson lleva ese nombre en honor a James Parkinson, un médico británico que fue el primero en describirla de forma detallada en 1817.
¿Quién fue James Parkinson?
James Parkinson (1755–1824) fue un cirujano, farmacéutico y paleontólogo aficionado londinense. En 1817 publicó un pequeño pero influyente ensayo titulado:
«An Essay on the Shaking Palsy»
En él describió por primera vez los síntomas de lo que hoy conocemos como enfermedad de Parkinson, basándose en la observación clínica de varios pacientes que presentaban temblores, rigidez muscular, lentitud de movimientos y problemas posturales.
Aunque él no sabía qué causaba la enfermedad, su descripción fue tan precisa que décadas después el neurólogo francés Jean-Martin Charcot, considerado el padre de la neurología moderna, propuso que la enfermedad llevara su nombre en reconocimiento a su aporte.
Un fármaco prometedor contra los daños mitocondriales
Para inducir síntomas similares al Parkinson, Romero y sus compañeros utilizaron rotenona, un pesticida retirado del mercado precisamente por sus efectos neurodegenerativos en humanos. “La rotenona inhibe el complejo I de la cadena transportadora de electrones mitocondrial, lo que provoca una producción excesiva de especies reactivas de oxígeno (ROS), dañando las mitocondrias”, indica. En C. elegans, este tratamiento desencadenó efectos muy similares a los observados en pacientes: reducción de la esperanza de vida, disminución de la movilidad, del bombeo faríngeo y de la frecuencia de defecación, todos indicadores de un colapso progresivo de la actividad muscular. Fue en ese contexto adverso cuando el CGP37157 mostró su capacidad para revertir parcialmente —e incluso completamente, en algunos parámetros— los daños causados por la rotenona. “Vimos mejoras claras en casi todos los indicadores alterados. En los niveles de ROS y en el potencial de membrana mitocondrial, los gusanos tratados llegaron a valores similares a los controles sanos”, comenta. Aunque la actividad muscular no se recuperó al 100 %, la mejoría fue notable. La única excepción fue la respiración mitocondrial, donde no se observaron cambios, posiblemente por mecanismos adaptativos celulares.
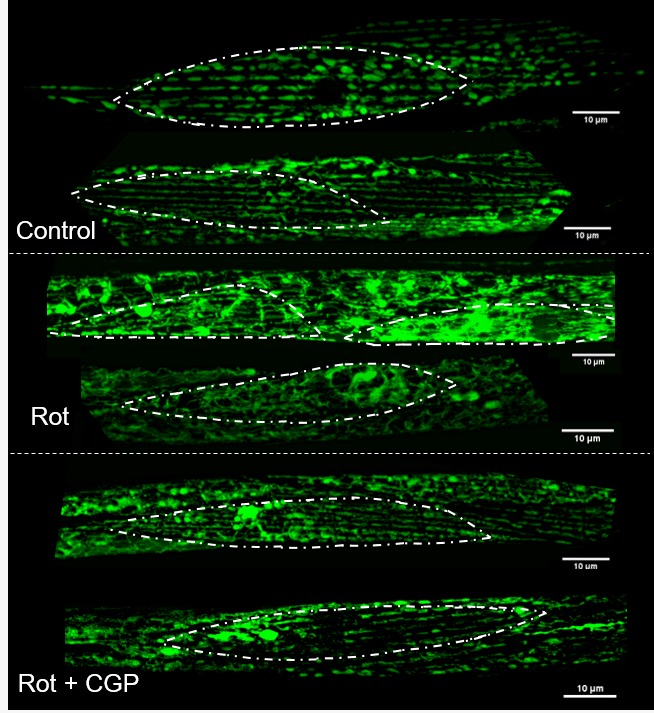
La imagen de la izquierda, incluida en el paper «Rescue of a Rotenone Model of Parkinson’s Disease in C. elegans by the Mitochondrial Na+/Ca2+ Exchanger Inhibitor CGP37157«, muestra en verde las mitocondrias de las células musculares de un gusano, gracias al uso de una cepa mutante que expresa GFP (una proteína fluorescente verde) específicamente en estas organelas. Las áreas delimitadas en blanco indican células musculares individuales. En condiciones normales, las mitocondrias siguen un patrón lineal alineado con los sarcómeros, lo que refleja una estructura y función correctas. En el modelo tratado con rotenona, el compuesto que comentábamos que daña las mitocondrias, este patrón se pierde, observándose agregados que sugieren alteraciones estructurales y funcionales. Con el tratamiento con CGP, un compuesto potencialmente protector, se empieza a recuperar el patrón lineal, lo que indica una mejora parcial en la organización y función mitocondrial.
Pero, ¿por qué el calcio es tan importante en el contexto del Parkinson? Silvia aclara que no se refiere al calcio de los huesos, sino al ion Ca²⁺, un mensajero intracelular clave que regula numerosos procesos fisiológicos. “Cada compartimento celular, como las mitocondrias, necesita mantener concentraciones precisas de calcio. Cuando este equilibrio se rompe, surgen problemas. En Parkinson, se ha observado sobrecarga de calcio mitocondrial en neuronas dopaminérgicas, pero aún no sabemos si esto es causa o consecuencia de la enfermedad”, señala.
A pesar del entusiasmo por los resultados, la científica mantiene una mirada realista: “Ojalá pudiéramos decir que este fármaco significase la cura para el Parkinson, pero aún queda mucho, mucho por estudiar”. El siguiente paso se centraría en probarlo en otros modelos animales más complejos, como ratones, antes de considerar su aplicación clínica.
Además, están explorando el uso de técnicas como el ARN de interferencia para inhibir genes específicos relacionados con los canales de calcio, lo que abre nuevas líneas para investigar la relación entre el envejecimiento, la disfunción mitocondrial y las enfermedades neurodegenerativas.
Lejos de limitarse al Parkinson, los hallazgos apuntan más lejos. “El CGP37157 podría tener utilidad en otras enfermedades neurodegenerativas. De hecho, en nuestro grupo también estamos viendo resultados prometedores en modelos de Alzheimer”, apunta la científica. El futuro de su investigación pasa por seguir desentrañando el papel del calcio en el deterioro neuronal, siempre desde una ciencia paciente, rigurosa y comprometida. Desde su tesis en el IBGM, Silvia Romero ha demostrado que incluso los organismos más diminutos pueden esconder grandes respuestas. Y que, a veces, la clave para comprender una enfermedad humana puede estar ubicada en el interior de un pequeño gusano transparente.